2022-09-12今日SH688266股票最新净值和交易情况
医药魔方:
氘可来昔替尼是全球首款获批上市的TYK2抑制剂
9月10日,百时美施贵宝(BMS)宣布,其TYK2抑制剂氘可来昔替尼(deucravacitinib)治疗斑块状银屑病的上市申请已获FDA批准,商品名为Sotyktu。,国家药品监督管理局也于7月15日受理该药物的上市申请。

银屑病是一种广泛流行的、慢性、系统性免疫介导疾病,严重影响患者的身体健康、生活和工作,全球至少有1亿人受此疾病困扰。斑块状银屑病以皮肤表面明显的圆形或椭圆形斑块上覆盖有银白色鳞屑为特征。现有系统性治疗方案能起到一定治疗效果,但无法满足患者的治疗需求,仍有许多中重度银屑病患者未得到充分治疗甚至未得到治疗。
氘可来昔替尼是一款具有独特作用机制的口服高选择性酪氨酸激酶2(TYK2)变构抑制剂。其通过选择性靶向TYK2抑制参与多种免疫介导疾病发病机制的关键细胞因子(如IL-23、IL-12和I型干扰素)的信号传导。氘可来昔替尼通过与TYK2的调节结构域结合实现高度选择性,促成TYK2及其下游功能的变构抑制。在生理浓度范围内,氘可来昔替尼选择性地抑制TYK2,且在治疗剂量下不抑制JAK1、JAK2或JAK3。

FDA本次批准是基于2项关键III期临床试验(POETYK PSO-1 和POETYK PSO-2)的积极结果。两项试验均为全球性、多中心、双盲、随机、安慰剂和阳性药物对照研究,分别纳入了666例患者和1020例患者,旨在评估氘可来昔替尼对比阿普米司特(apremilast)和安慰剂治疗中重度斑块状银屑病成人患者的疗效和安全性。共同的主要终点为第16周时银屑病面积与严重性指数(PASI)评分改善75%以上和sPGA 0/1(静态医生总体评估皮肤症状完全清除/几乎完全清除)的患者比例。
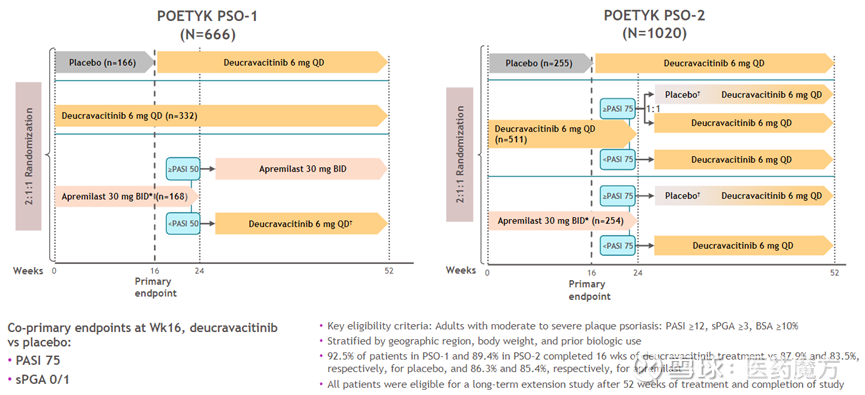
数据显示,第16周时,与安慰剂组和阿普米司特组相比,氘可来昔替尼组PASI评分改善75%以上和sPGA 0/1的患者比例显著增加。试验还达到了所有次要终点,氘可来昔替尼在症状负担和生活质量测量值上表现出显著且具有临床意义的改善。此外,氘可来昔替尼耐受性良好,因不良事件导致的停药率低。


今年5月,BMS公布了POETYK PSO长期扩展研究(POETYK PSO-LTE)进行2年后的数据。该研究是一项开放标签、多中心III期临床试验,共纳入1452例患者,旨在评估氘可来昔替尼治疗中重度斑块状银屑病成人患者的长期安全性和有效性,预计于2026年7月完成。数据显示,在第60周时,氘可来昔替尼组PASI评分改善75%以上的患者比例为77.7%,sPGA 0/1的患者比例为58.7%。
BMS首席医疗官Samit Hirawat博士表示:“今日Sotyktu获批,对于那些对局部和常规治疗不满意的中度至重度斑块状银屑病患者来说是激动人心的一天。这是BMS的另一项非凡成就,因为我们提出了一种新的作用机制,这是近10年来批准的第一个用于治疗中度至重度斑块状银屑病的口服药物。我们相信Sotyktu是治疗这类患者的一个突破,并且我们对它在其他免疫介导疾病中的潜力感到兴奋。”
此外,针对TYK2靶点,BMS还有另外2款药物(BMS-986202和BMS-986322)在研,BMS-986202处于II期阶段,BMS-986322处于I期阶段。
除银屑病外,氘可来昔替尼还被开发用于治疗银屑病关节炎、头皮银屑病、系统性红斑狼疮和炎症性肠病等多种免疫性疾病。可以说,BMS是TYK2抑制剂赛道的资深玩家了。
TYK2抑制剂全球研发进展
截至目前,全球共30款在研TYK2抑制剂,除氘可来昔替尼外,共19款进入临床阶段,其中2款处于III期临床阶段,4款处于II期临床阶段。

brepocitinib
brepocitinib是一款TYK2/JAK1双重抑制剂,最早由辉瑞开发。
2022年6月,辉瑞与Roivant共同成立Priovant,并授予Priovant该产品和另一款TYK2抑制剂ropsacitinib的全球开发权以及美国和日本的商业化权,而辉瑞将持有Priovant公司25%的股权。,试验共纳入225例患者,预计2024年12月完成。

杰克替尼(jaktinib)
杰克替尼是一款由泽璟制药自主研发的非选择性JAK抑制剂
,其对JAK1、JAK2、JAK3和TYK2具有显著的抑制作用,且对JAK2和TYK2的抑制作用最强。另外,杰克替尼还可以通过抑制激活素受体1(ACVR1)活性降低铁调素转录,改善铁代谢失衡,增加血红蛋白,降低骨髓纤维化患者贫血发生率和减少输血依赖。
Momelotini

今年6月,泽璟制药宣布杰克替尼治疗骨髓纤维化的III期研究在期中分析中达到了预设的主要终点。基于此,泽璟制药将向CDE提交新药上市申请前(Pre-NDA)的沟通交流申请。
目前,杰克替尼正在开展针对骨髓纤维化、斑秃和特应性皮炎的III期临床试验。此外,
BMS-986202和BMS-986322
BMS-986202是BMS在氘可来昔替尼的基础上进行结构改造得到的新型TYK2抑制剂,目前正在进行针对银屑病的II期临床试验。

NDI-034858
NDI-034858是一款由Nimbus开发的TYK2变构抑制剂,是通过基于结构的药物设计方法得到的。目前正在进行针对斑块状银屑病和银屑病关节炎的II期临床试验。在一项针对斑块状银屑病的I期临床研究中,NDI-034858表现出改善多种疾病病理学指标并使银屑病中失调的分子和炎症通路正常化的作用。值得注意的是,细胞实验数据显示,NDI-034858对TYK2的选择性优于氘可来昔替尼。
ropsacitinib
ropsacitinib是辉瑞开发的一款选择性TYK2抑制剂,目前正在开展针对溃疡性结肠炎、银屑病和化脓性汗腺炎的II期临床试验。

TLL018
TLL018是一款由高光制药开发的高效的、选择性的口服JAK1(IC50=4nM)和TYK2(IC50=5nM)双重抑制剂,它对JAK2或JAK3的效力大于1µM。目前正在开展针对类风湿性关节炎和溃疡性结肠炎的II期临床试验。
泽璟制药-U(SH688266)百时美施贵宝(BMY)诺华制药(NVS)
医药魔方:
9月10日,CDE官网显示辉瑞JAK3抑制剂利特昔替尼胶囊上市申请获受理,用于治疗12岁及以上青少年和成人斑秃。2020年12月,利特昔替尼该适应症被CDE纳入突破性疗法。

9月9日,辉瑞还宣布美国FDA和欧洲EMA均受理了每日口服1次JAK3抑制剂ritlecitinib(利特昔替尼)的新药上市申请,用于12岁及以上青少年和成人斑秃患者,预计FDA和EMA分别在2023年第二季度、第四季度作出决定。FDA曾在2018年9月授予ritlecitinib治疗斑秃的突破性疗法资格。
此次在欧美的上市申请是基于既往公布的IIb/III期ALLEGRO研究和正在进行的III期ALLEGRO- LT长期研究的结果。
ALLEGRO是一项随机、双盲、安慰剂对照、IIb/III期研究,旨在评估ritlecitinib治疗12岁及以上斑秃患者(n=718)的疗效和安全性。入组患者至少有50%的头发因斑秃而脱落,包括全秃(头发全部脱落)和普秃(全身毛发均脱落)患者,并且已持续6个月至10年的斑秃发作。患者随机接受每日1次ritlecitinib 30mg或50mg(接受或不接受1个月的初始治疗:每日1次ritlecitinib 200mg)、ritlecitinib 10mg或安慰剂治疗。
主要终点为第24周时绝对SALT评分≤20,对ritlecitinib治疗有反应的头皮毛发再生患者比例。SALT是一种测量头皮脱发量工具,评分越高,脱发越严重。结果显示,每日服用30mg和50mg ritlecitinib治疗的患者(无论是否接受为期4周的初始治疗)在24周时,头皮毛发覆盖率≥80%的患者比例显著高于安慰剂组。
总的安全性数据表明,ritlecitinib在成人和青少年患者中耐受性良好。最常见的不良事件为头痛、鼻咽炎和上呼吸道感染。
ALLEGRO-LT是一项正在进行的开放标签的、长期的III期研究,旨在评估ritlecitinib在脱发率为25%或以上的成人斑秃患者和脱发率为50%或以上的12岁青少年斑秃患者中的安全性和有效性。
斑秃是一种以斑块状脱发为特征的自身免疫性疾病。这种脱发通常发生在头皮上,但也会影响眉毛、睫毛、面部毛发和身体的其他部位。斑秃患者的症状由免疫细胞攻击健康毛囊引起,导致头发脱落。斑秃平均发病年龄在25至35岁之间,但也可影响老年人、儿童和青少年,无明显性别差异。斑秃严重影响患者健康和生活质量,可能引起严重心理障碍,包括抑郁和焦虑。美国约有680万人患有斑秃,全球约有1.47亿人患有斑秃。
Ritlecitinib是新一代共价激酶抑制剂,对表达于肝细胞癌(TEC)激酶家族中的酪氨酸激酶成员和Janus激酶3(JAK3)具有高选择性。实验室研究证明,ritlecitinib可阻断信号分子和免疫细胞活性,这些信号分子和免疫细胞被认为是导致斑秃的原因。与第一代泛JAK抑制剂相比,ritlecitinib在降低毒性方面更有优势。
信达生物(01801)泽璟制药-U(SH688266)辉瑞(PFE)
老施聊医疗:
泽璟制药-U(SH688266) 主力资金是不是吸筹吸够了? 借着杰克替尼申请上市玩一波?
IPO小助手V:
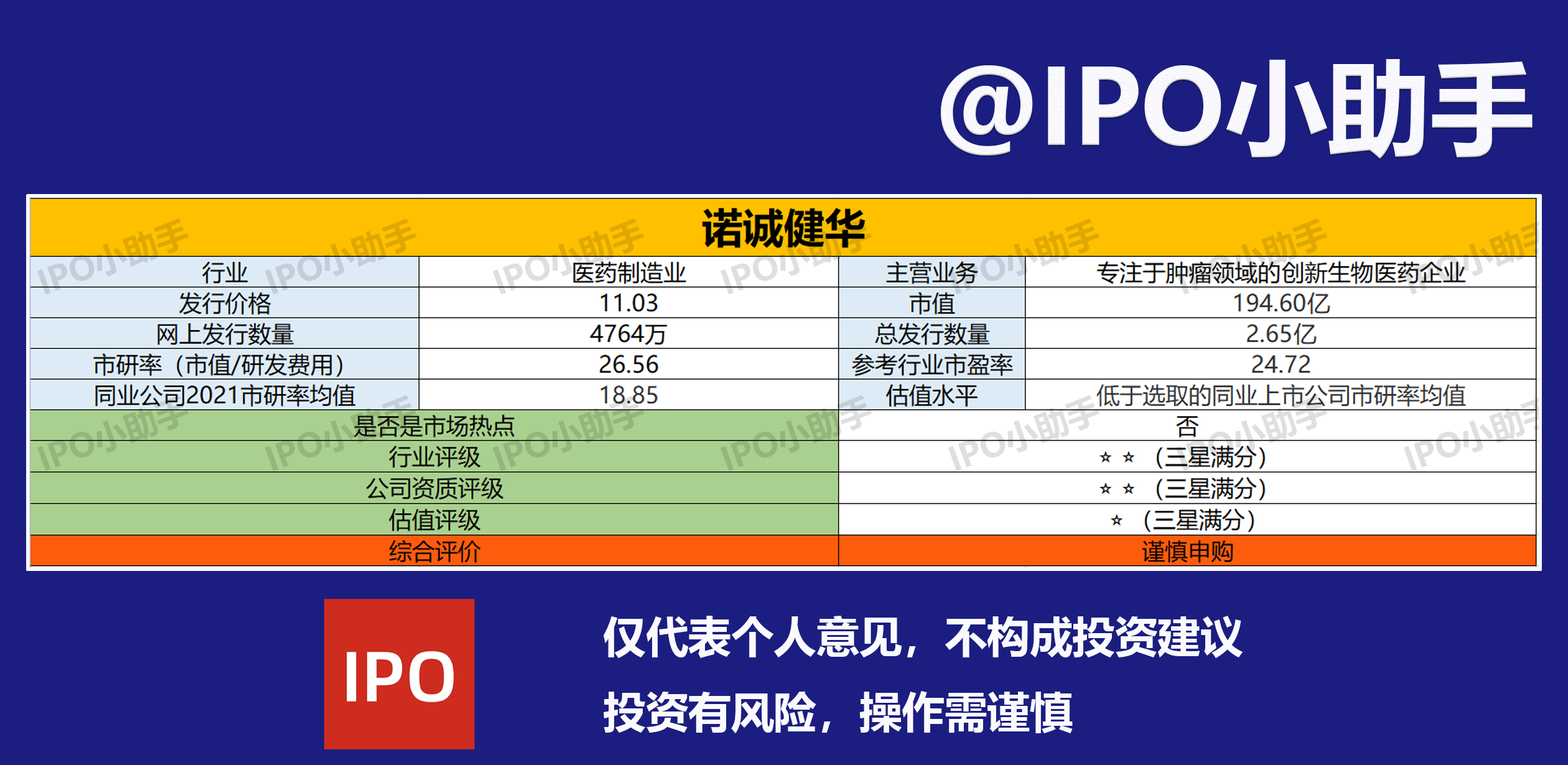
公司资质评级(⭐⭐)
上市地点:上海证券交易所科创板
诺华是一家从事创新药的研发、生产及商业化的创新生物医药企业,专注于肿瘤和自身免疫性疾病等存在巨大未满足临床需求的领域,在全球市场内开发具有突破性潜力的同类最佳或同类首创药物。
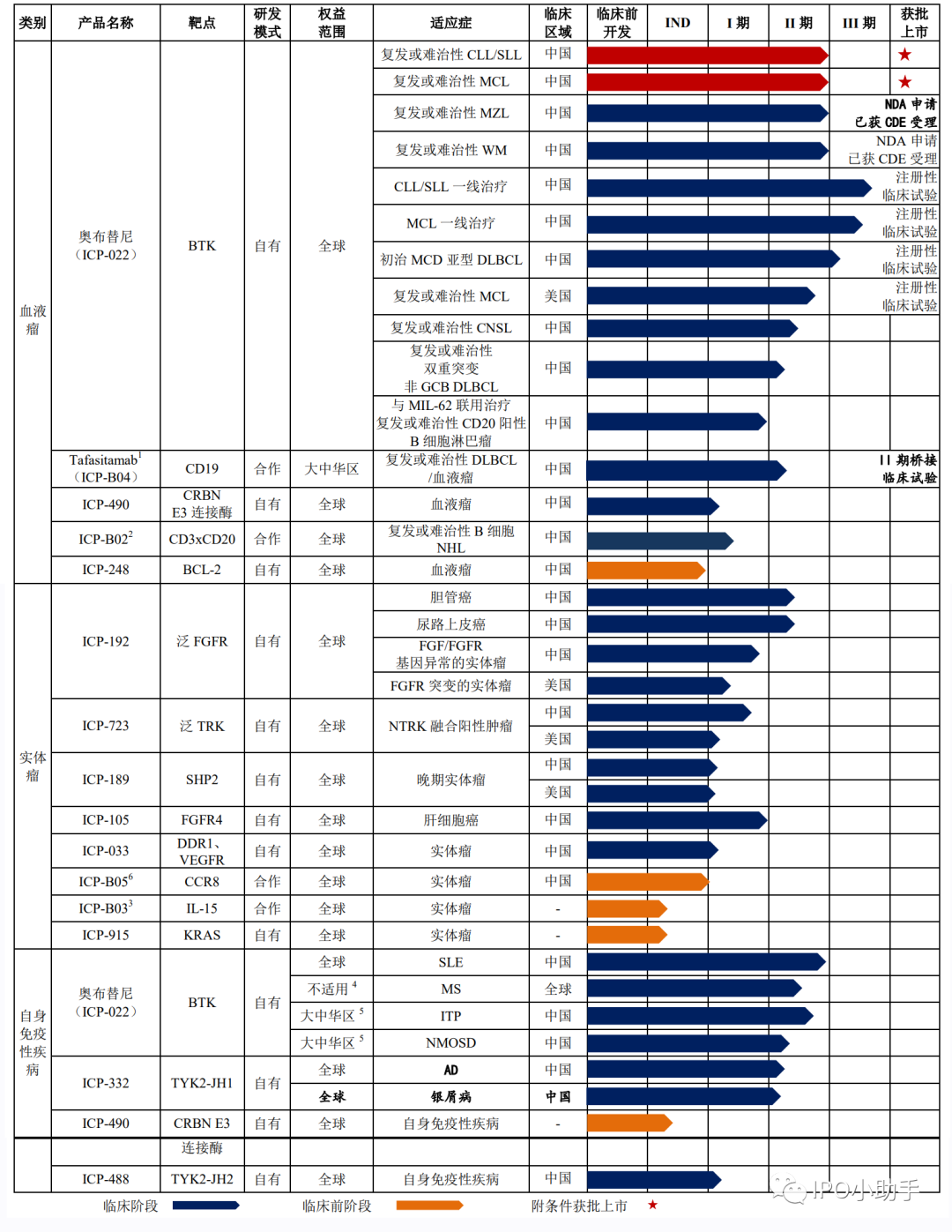
截至目前,公司的主要产品之一奥布替尼已于 2020 年 12 月获得国家药监局附条件批准上市,Tafasitamab 已获批在博鳌超级医院作为临床急需进口药品使用,11 款产品处于 I/II/III 期临床试验阶段,5 款产品处于临床前阶段。
2019 年度至 2020 年度,公司主要收入来源于技术服务及检测试验收入,均为其他业务收入;2021 年度,因奥布替尼获批上市且公司与 Biogen 就奥布替尼达成一项授权合作,公司有了主营业务收入,包括药品销售收入、技术授权及研发服务收入。

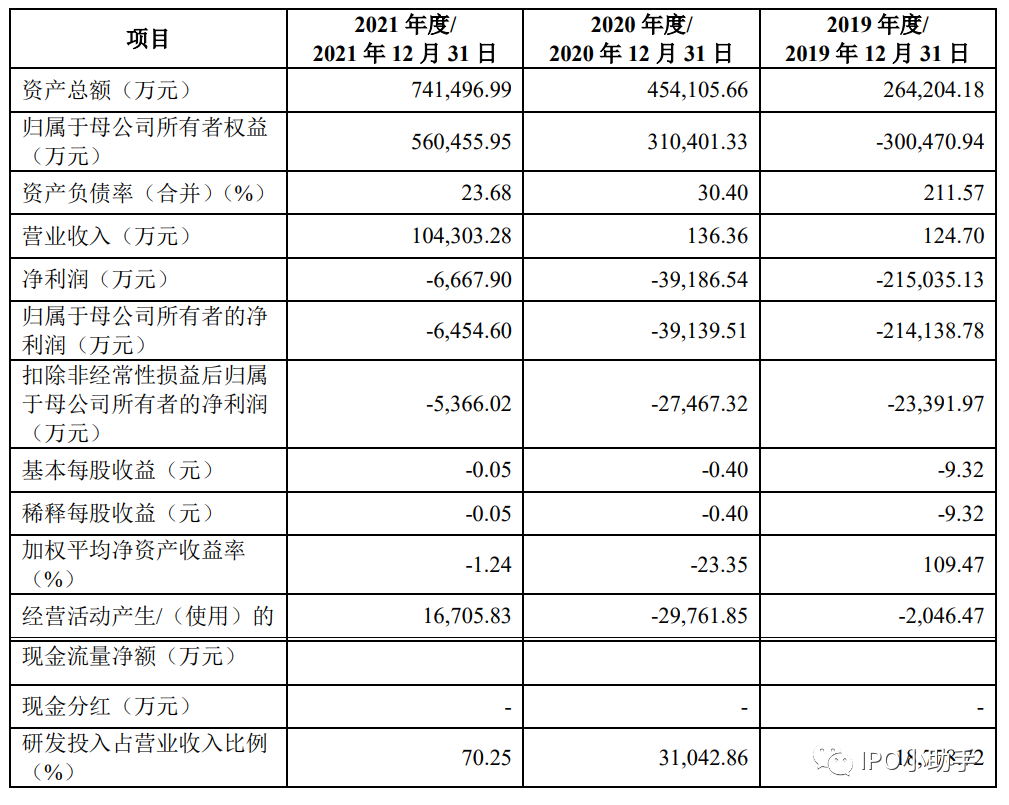
财务数据如下表所示:

目前,中国的抗肿瘤药物市场以化疗药物为主导,占整体市场的63%以上。在创新药不断研发及上市、患者支付能力提高等多种因素驱动下,预计2030年靶向治疗将成为市场主导,占整体市场45%以上的份额。
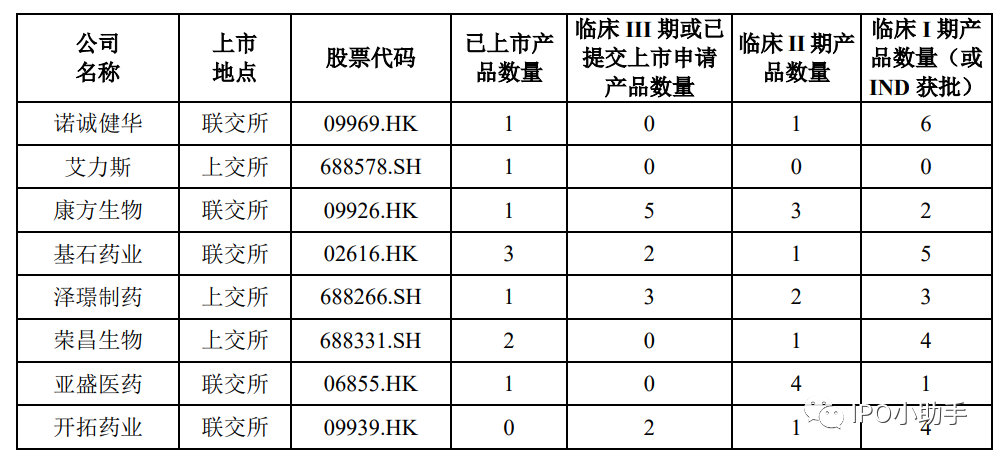
截至 2021 年 12 月 31 日,诺华与同行业可比公司在在研产品进度等方面具体比较如下:
行业评级(⭐⭐
)
诺华属于医药制造业,专注于肿瘤和自身免疫性疾病等领域创新药的研发、生产及商业化。
癌症作为最恶性的人类疾病之一,拥有死亡率高、预后差、治疗费用昂贵的特点,是目前最急需解决的人类医疗卫生问题之一。近年来,全球癌症新发病例数持续增长。根据弗若斯特沙利文分析,全球癌症新发病例数从 2016 年的 1,721 万人增加至 2020 年的 1,929 万人。其中,中国新发患者数量复合年增长率高于全球平均水平,预计到 2030 年新发患者人数将超 581 万人,占全球新发患者人数的 24.2%。
近年来,全球抗肿瘤药物市场蓬勃发展。目前全球抗肿瘤药物市场规模从 2016 年 的 937 亿美元增长到 2020 年的 1,503 亿美元,复合年增长率为 12.5%,并且预计到 2025 年,市场规模将达到 3,048 亿美元,复合年增长率为 15.2%。到2030 年,抗肿瘤药物市场将进一步增长到 4,825 亿美元,2025 年至 2030 年的复合年增长率为 9.6%。
在中国,抗肿瘤药物市场近年来一直保持稳步增长趋势,市场规模在 2020 年达到 1975亿元,2016至2020年间的复合年增长率为12.1%。预计中国抗肿瘤药物市场在2025 年将会达到 4162亿元,复合年增长率为 16.1%。到 2030 年,抗肿瘤药物市场将 达到 6831 亿元,2025年至 2030 年的复合年增长率为 10.4%。

估值评级(⭐
)
因诺华尚未盈利,选取市值/研发费用作为估值指标,选取的同业上市公司均值为18.85,低于诺华。

【小助手观点】
诺华是一家专注于肿瘤和自身免疫性疾病等领域的创新药企,目前尚未盈利,因为新上市的药品持续发力,报告期内公司的亏损逐渐在减少,不过今年上半年净利润同比下滑地多。诺华的市研率高于选取的同业上市公司市研率均值,建议谨慎申购。
【风险提示】文章内容仅代表个人观点,不构成投资建议,请理性看待。
@今日话题 @雪球达人秀 @雪球征文 #新股申购##打新# 诺诚健华(SH688428)泽璟制药-U(SH688266)基石药业-B(02616)
美股滚雪球:
罗氏(Roche)收购了西雅图的未上市公司Good Therapeutics,以加强其免疫肿瘤业务组合。
根据该协议,罗氏将支付2.5亿美元用于购买Good的股份,并根据预先确定的开发、监管和商业里程碑的实现情况支付额外款项。
Roche将获得Good公司pd -1调控的条件活性IL-2项目的权利,以及开发pd -1调控IL-2受体激动剂疗法的平台技术的独家权利。
君实生物-U(SH688180)信达生物(01801)泽璟制药-U(SH688266)
未来智库:
(报告出品方:广发证券)
一、坚持创新驱动,研发实力和商业化能力不断成熟
泽璟制药是一家专注于肿瘤、出血及血液疾病、肝胆疾病等多个治疗领域的创 新驱动型新药研发企业,致力于研发和生产具有全球自主知识产权、安全、有效、 患者可负担的创新药物,以满足国内外巨大的临床需求。成立以来,公司坚持独立 自主的原始创新和改良再创新并重的发展策略,针对经科学和临床验证的药物靶点, 已建立先导药物发现和优化、候选药物的评价和确立、药物临床前和临床研究、药 品注册、产业化和市场营销等较为完整的新药研发和商业化体系。同时,公司先后 承担了5项国家“重大新药创制”、1项国家科技型中小企业技术创新基金、多项江 苏省级科技项目;公司已累计申请发明专利271项,其中有110余项获得了中国、 美国和欧盟等国家和地区的发明专利授权。
(一)首个产品上市,商业化能力快速成长
2021年6月,公司1类新药甲苯磺酸多纳非尼片一线治疗晚期肝癌获得上市批 准。多纳非尼上市后,先后被纳入国家医保目录和多个指南,上市首年取得药品销 售收入1.63亿元,2022上半年收入1.05亿元。基于此首个产品上市,公司于2021 年实现营业收入1.90亿元,同比增长588.19%,归母净利润为-4.51亿元,扣非归母 净利润为-4.98亿元;2022年上半年,公司实现营业收入1.05亿元,归母净利润2.47亿元,扣非归母净利润-1.63亿元。
(二)持续加大研发投入,三大平台助力高效研发
研发投入不断增加,近三年累计投入已超过10亿元。2021年研发支出高达5亿 元,同比增加60%,2022年上半年研发投入2.6亿元,同比增加30%。随着研发投 入的增加,公司多个项目取得里程碑进展,同时研发实力也大幅提升。目前公司已 建立起三个研发中心,分别为:(1)江苏昆山:药物生产和产业化转化中心;(2)上 海张江:小分子药物研发、临床及临床前研发;(3)美国加州:子公司GENSUN, 负责大分子药物创新研究、设计和筛选。

公司现有三大国际领先的研发及产业化平台。(1)精准小分子药物研发及产业 化平台:该平台是泽璟制药小分子新药研发的基础。公司核心技术之一是全球领先 的药物稳定技术,有效地保证新药开发的成功率;同时,公司采用构效关系筛选、 计算机辅助模拟设计、新作用模式分子设计、新晶型等多种新药研发技术开发具有 自主知识产权的小分子新药。目前已有产品上市、多个新药处于不同研发阶段。(2) 复杂重组蛋白新药研发及产业化平台:该平台是泽璟制药大分子新药研发的基础, 公司通过自主研发的复杂重组蛋白核心技术,已率先成功研发多个重组蛋白药物。 (3)双/三靶点抗体研发平台:公司和控股子公司GENSUN致力于发现和开发新型抗 体;目前拥有三个候选药物研发平台TriGen、CheckGen和Tgen,基于此平台已有 2个产品(ZG005、ZGGS18)获得中美两地IND批准,标志着公司的新型抗体研 发平台逐步进入收获期。
(三)注重人才引进与团队建设,新药研发和商业化体系逐渐成熟
优秀的研发团队为新药研发提供技术保障。公司的核心研发管理团队具备优秀 的创新能力、丰富的新药项目管理经验,大部分核心团队成员均具有在国际知名药 企的新药研发工作经验和海归背景,曾领导或参与了多个国内外新药的研发和上市。 同时,公司注重引进国内和国外优秀的研发人才,组建了具备扎实的专业素养和丰 富的新药开发经验的专业团队。截至目前,公司拥有311名全职研发人员,占公司 总人数比例为40%,硕士以上学历人员合计占研发人员的比例为47%。丰富的人才 储备将为公司创新药研发提供很好的保障。 拥有自主的商业化生产能力。公司目前已按照GMP标准建成3个车间:(1)小分 子药物片剂生产车间及其配套设施,已通过GMP动态核查,目前已实现商业化;(2) 小分子药物胶囊生产车间及其配套设施,已获得药品生产许可证,可进行商业化和 临床样品生产;(3)重组蛋白药物生产车间(外用重组人凝血酶和注射用重组人促甲 状腺激素)及其配套设施,近期正在积极准备GMP检查等相关工作用于重组人凝 血酶的生产;(4)正在建设抗体药物生产车间。公司同时拥有具备GMP生产及管理 经验的商业化生产团队,为临床用药供应和新药上市销售提供有力的产业化保障。
建立了卓越的临床合作体系。公司已建立了全国相关领域的顶尖临床专家网络, 与国内知名的三甲医疗机构合作开展了广泛、紧密的临床试验合作,这为公司产品 管线临床试验的高质量运行以及产品品牌的培育等打下了坚实的基础。同时公司也 积极与流通领域与互联网创新企业开展合作,包括与国药集团,上海医药的深度合 作,以及与多个互联网创新企业进行合作共同构建新型服务模式。 积极培育市场营销方面的优势。商业运营团队的主要骨干拥有多年肿瘤领域的 商业运作经验和管理经验,曾在多家跨国制药企业有多个重磅肿瘤和特药产品在中 国的商业化成功经验。这支专业化的商业运营团队,坚持专业化的学术推广模式, 已建立较为完善的国内市场营销管理体系,分为销售部、市场部、医学事务部和商 务及多元化部门,各部门分工明确,相辅相成。目前公司营销网络基本覆盖全国各 省市,确保各区域市场销售管理的持续稳定。截至目前,公司的商业化团队已经扩 增至300多人,今年的目标是覆盖1000+家目标医疗机构,3000+目标医生,同时 也在拓展局部地区的双通道药房渠道。
二、自主创新推动管线进展,差异化竞争优势凸显
公司围绕以肿瘤为重点的大病种和罕见病布局,在肿瘤、自身免疫病、出血及 血液疾病等治疗领域建立起一条产品丰富、差异化优势明显的研发管线。多纳非尼 (泽普生®)于2021年6月成功获批上市,用于一线治疗晚期肝癌,2022年8月用于 治疗碘难治性分化型甲状腺癌的适应症也获得批准。公司目前拥有16个在研药品、 45项在研项目,其中除多纳非尼外,3个在研药品(外用重组人凝血酶、杰克替尼 片和注射用重组人促甲状腺激素)的8项适应症处于NDA、III期或注册临床试验阶 段,6个在研药品(杰克替尼乳膏、奥贝胆酸镁片、ZG19018片、ZG005粉针剂、 奥卡替尼胶囊以及注射用ZGGS18)处于I期或II期临床试验阶段,6个在研药品处 于临床前研发阶段(ZG1905、ZG170607注射剂、ZG006粉针剂、ZGGS001粉针 剂、GS11粉针剂和GS15粉针剂)。
(一)甲苯磺酸多纳非尼片(泽普生®)
甲苯磺酸多纳非尼片(泽普生®,多纳非尼)是泽璟制药自主研发的一种口服 多靶点、多激酶抑制剂类小分子抗肿瘤药物。较已上市进口小分子药物,具有突出 的代谢动力学特性、更好的安全性和有效性。多纳非尼是1类创新药,泽璟制药拥 有该产品独立的自主知识产权,共获得4项“十二五”和“十三五”国家重大新药 创制科技重大专项立项支持。临床前药理学研究证实,多纳非尼既可抑制VEGFR、 PDGFR等多种受体酪氨酸激酶的活性,也可直接抑制各种Raf激酶,并抑制下游的 Raf/MEK/ERK信号传导通路,达到抑制肿瘤细胞增殖和肿瘤血管形成的效果,发 挥多重抑制、多靶点阻断的抗肿瘤作用。
两项适应症已获批上市,多项联合治疗试验同步开展。除肝癌适应症外,多纳 非尼用于治疗甲状腺癌的适应症也获批上市,为多纳非尼片的销售增长提供了新的 动力。多纳非尼具有广谱的抗肿瘤效果和良好的安全性,同时也具有显著的调节肿 瘤免疫微环境的作用。因此,多纳非尼拥有与肿瘤免疫治疗药物(I/O)联合治疗 的潜力,有望进一步提升肿瘤治疗的疗效,基于此公司正在与多家拥有抗PD1/PD-L1抗体或者双特异抗体产品的制药企业进行合作,开展多项联合治疗晚期实 体瘤的临床研究,以期获得更大的市场空间。
1. 多纳非尼治疗既往未接受过全身系统性治疗的不可切除肝细胞癌(HCC)
2021年6月,多纳非尼一线治疗晚期肝细胞癌适应症已经获批上市销售。并于 2021年12月成功进入国家医保目录,是中国制药企业自主研发上市的第一个一线 治疗晚期肝细胞癌的小分子靶向创新药物,也是全球首个一线治疗晚期肝细胞癌头 对头获得优效结果的国产靶向新药。此外,多纳非尼一线治疗晚期肝癌先后被列入 《原发性肝癌诊疗指南(2022年版)》、《新型抗肿瘤药物临床应用指导原则 (2021年版)》、《CSCO原发性肝癌诊疗指南2020》(均为I级专家推荐和1A类 证据)以及《肝癌靶向治疗专家共识》、《中国肝癌多学科综合治疗专家共识》 《中国肝癌经动脉化疗栓塞治疗(TACE)临床实践指南(2021年版)》和《中国 原发性肝细胞癌放射治疗指南(2020 年版)》等多项临床指南和诊疗规范中,已 经成为晚期肝癌一线治疗领域的临床指南推荐的首选靶向药物。
中国肝癌患者与欧美国家明显不同,具有高度的异质性,本土临床数据至关重 要。中国是世界上肝癌发病率最高的国家,根据CA: A Cancer Journal for Clinicians杂志发布的数据,2020年我国肝癌新发病例为41万,死亡病例为39万, 约占全球新发病例和死亡病例的一半。我国乙型肝炎病毒感染相关HCC的比例较高, 且80%的HCC患者在初诊时已达中晚期,失去根冶机会;同时大多数患者合并有基 础肝病(肝炎和肝硬化),肝功能较差,导致治疗困难、治疗效果差,患者的生存 期很短。因此,在肝癌诊疗中我国本土大样本临床研究及其数据至关重要。 顶刊数据证明唯一优效,全球首个一线治疗晚期HCC中头对头索拉非尼获得 OS优效结果的小分子靶向新药,更适合中国肝癌患者。2021年6月30日,多纳非 尼对比索拉非尼一线治疗晚期肝细胞癌(HCC)的开放、随机、平行对照、多中心 II/III期临床研究(ZGDH3研究)于国际著名临床肿瘤期刊《临床肿瘤学杂志》 (Journal of Clinical Oncology,JCO)上全文正式在线发表,多纳非尼成为首个登 顶国际肿瘤学领域顶级期刊的中国原研肝癌小分子靶向药物。 该研究共纳入668例 患者(意向治疗[ITT]人群),其中659例(多纳非尼组328例,索拉非尼组331例) 患者纳入全分析集(FAS)。

有效性方面:(1)在FAS中,多纳非尼组的中位OS达到了12.1个月,而索拉非 尼组为10.3个月,差异具有统计学显著意义(HR 0.831,95%CI 0.699-0.988, p=0.036(3);(2)多纳非尼组18个月OS率高于索拉非尼组(35.4% v 28.1%; P = 0.0460);(3)ITT人群的OS结果与FAS相似,多纳非尼组和索拉非尼组的中位OS 分别为12.0个月和10.1个月(HR 0.839; 95% CI 0.706-0.996,p=0.0309);(4)两 组客观缓解率(ORR)分别为4.6% vs 2.7%(p=0.2448);5)两组疾病控制率 (DCR)分别为30.8% vs 28.7%(p=0.553(2),但是多纳非尼组24周的DCR明显 优于索拉非尼组(20.7% vs 15.7%)。随后的分析证实,第24周的DCR对长期生 存率有显著影响(P<0.0001)。除此之外,在安全性方面,多纳非尼组也表现出了更 低的不良事件发生率,这为患者的后续治疗提供了更多机会。
在试验预设的各个亚组分析中,多纳非尼组在既往未经过局部治疗、BCLC分 期为C期、无门静脉侵犯和/或肝外转移、无后线免疫检查点抑制剂治疗及无后线系 统化疗的亚组中显示出多纳非尼组总生存期显著优于索拉非尼组,特别是对无门静 脉侵犯和/或肝外转移的相对病情较轻和更早期的患者,多纳非尼组的中位OS达到 了21.7个月,而索拉非尼组为15.6个月,差异具有统计学显著意义(HR 0.655, 95%CI 0.451–0.95(3)。这些数据提示,多纳非尼对于病情较轻和更早期的患者,可以显著提高其生存期,达到更大的临床获益。
以上ZGDH3研究成为自2007年以来,首个在单药与索拉非尼头对头、一线治 疗晚期HCC中获得OS优效的临床研究。并且在PFS、TTP、ORR、DCR等方面也 显示出较索拉非尼改善的趋势;此外,多纳非尼还表现出了更好的安全性和耐受性。 基于ZGDH3研究的优良结果,2020年CSCO《原发性肝癌诊疗指南》将多纳非尼 纳入晚期肝癌一线治疗的I级推荐药物。多纳非尼彻底打破了肝癌一线靶向治疗的 瓶颈,成为中国晚期HCC患者一线治疗的优选新药。
中国肝癌市场规模巨大,多纳非尼在本就数量稀缺的靶向药中优势明显。肝癌 药物市场是癌症药物市场中增速最快的子市场之一,目前肝癌靶向药物已经在临床 上初步展示出了其优势,治疗渗透率逐年上涨,预计在2030年达到40%以上。中国 肝癌靶向药物市场虽然起步较慢但放量迅速,临床未满足需求大,预计2030年肝癌 一线靶向药市场的规模将会达到160亿元左右。从目前的分析看,索拉非尼和仑伐 替尼均以纳入集采,主动推广的力度大大减少;仑伐替尼相比于多纳非尼一个最大 的差异是其在对比索拉非尼的试验中是非劣效,而多纳非尼则是优效且毒副作用更 小;贝伐单抗目前费用高且不能报销;淫羊藿素获批适应症是不适合或拒绝接受标 准治疗,且患者外周血复合标志物AFP、TNF-α、IFN-γ需满足至少两项指标的不可 切除的肝细胞癌(HCC)患者,这个适用人群与多纳非尼的适用人群有很大不同。 多纳非尼是目前一线治疗晚期肝癌中唯一一个优于索拉菲尼且安全的单药治疗药物, 纳入医保后,患者负担将进一步降低,公司将会充分利用这些优势拓展市场。
快速验证公司商业化能力,医保助力药物可及。距离获批上市仅42小时,公司 即顺利完成多纳非尼首单出库,迅速实现全国商业供货。上市后5个多月即被纳入 国家医保目录,从获批、商业供货到医保准入,公司商业化能力已经得到初步验证, 多纳非尼成为中国加快创新药纳入医保以满足临床迫切需求的具体实例。截至2022 年6月,已经进入医院429家、双通道药房342家,为后续销售放量奠定基础。截至 2022年6月底,多纳非尼已获得销售收入2.7亿元左右,2022年单二季度销售收入 6167万元,环比一季度增长41%。除国家医保目录外,多纳非尼也先后被纳入多个 省市的普惠性医保特定药品目录,这有助于公司进一步提高该药物在患者中的可负 担性和可及性,有利于进一步推动该药物的市场推广、提升销售规模。随着医保准 入医院持续增加,后续公司将进行更多的医学专业推广,患者使用数量有望不断增 加,销量有望稳步提升。

预计多纳非尼HCC销售峰值超过15亿元。(1)根据世界卫生组织国际癌症研究 机构(IARC)官网公布的数据,我国2020年肝癌新发患者数为41万人;(2)根据中 国临床肿瘤学会(CSCO)《原发性肝癌诊疗指南2020》中的介绍,我国原发性肝 癌的病理类型主要是HCC,占85~90%;(3)进入医保后,多纳非尼的治疗费用降低 69%至2592元/盒,一个月的用量为3盒。
2. 多纳非尼治疗局部晚期/转移性放射性碘难治性分化型甲状腺癌(RAIR-DTC)
国内甲状腺癌高发,其中放射性碘难治性分化型甲状腺癌预后较差且死亡率高, 药物需求巨大。中国甲状腺癌每年的新发病例占到全球的1/3,且5年生存率只有 84.3%,相比欧美国家的5年生存率98.3%还有较大差距,这也导致我国晚期甲状腺 癌病人相对较多。在局部晚期或转移性分化型甲状腺癌(DTC)病灶中,有 25%~50%的病灶表现出失分化的特点,病灶失去摄碘功能而无法从碘-131治疗手 段中获益,临床上称之为放射性碘难治性分化型甲状腺癌(RAIR-DTC)。这类患 者具有死亡高风险性,10年生存率仅为10%,平均预期生存时间仅为2.5~3.5年, 是目前甲状腺癌患者生存率难以进一步提升的主要瓶颈。目前该领域治疗药物虽有 索拉非尼、仑伐替尼两种进口药物上市,但发挥疗效的同时药物的不良反应常常导 致减量或停药,这制约了药物有效剂量的维持和疗效的持续。因此,RAIR-DTC领 域对疗效和安全性兼顾的新药仍存在较大的、未被满足的需求。
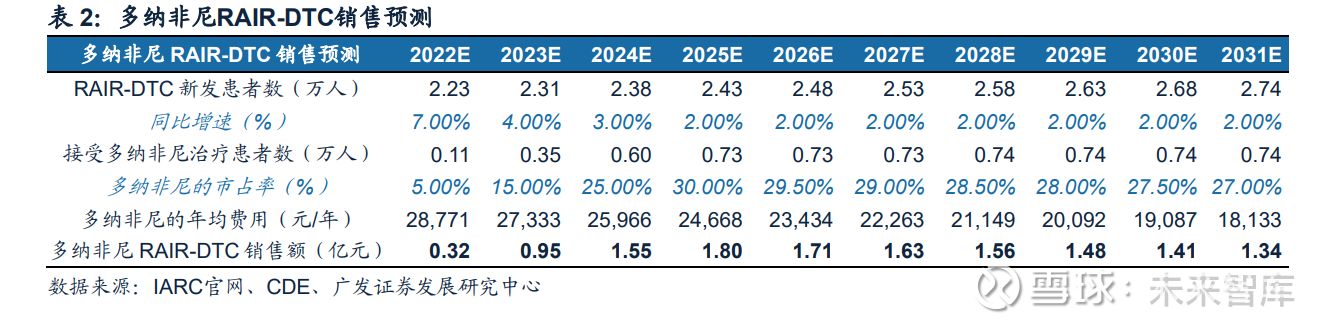
疗效和安全性兼顾,RAIR-DTC成为多纳非尼第二项获批适应症。多纳非尼治 疗RAIR-DTC的III期临床共入组191例患者(多纳非尼组128例,安慰剂组63例),是至今入组最多中国RAIR-DTC患者的研究。两组的mPFS分别是12.9和6.4个月 (HR 0.389,95% CI 0.251-0.605,p<0.0001),ORR(23.3% vs 1.7%, p=0.0002)也具有显著差异。中位OS未达到,在治疗后18个月的生存率分别为 88.3%和73.5%。安全性方面,多纳非尼组有56例(43.8%)发生≥3级的治疗相关 不良事件(TRAE),无治疗相关死亡发生。多纳非尼组最常发生的TRAE为高血 压(13.3%)和掌跖红肿综合征(12.5%)。此适应症已于2022年8月获得批准, 有望在2022年为公司贡献新的收入。 预计多纳非尼治疗RAIR-DTC销售峰值接近2亿元。(1)根据IRAC官网公布的数 据,我国2020年甲状腺癌新发患者数为22万人;(2)DTC是最常见的类型,占所有 甲状腺癌的90%以上,高达30%的DTC患者会发生复发,其中30%最终成为RAIRDTC,以此计算患者人数;(3)现有治疗RAIR-DTC的小分子靶向药物的中位治疗持 续时间为7.8(1.0-25.9)个月;(4)多纳非尼治疗RAIR-DTC适应症已于2022年8月 获批上市。
3. 多纳非尼治疗其它适应症
多纳非尼联合柔红霉素和阿糖胞苷治疗复发性急性髓系白血病(AML)的I期 试验正在进行中;多纳非尼还开展了数十项与肿瘤免疫治疗药物联合治疗晚期肿瘤 的研究,包括与JS001(抗PD1单抗,君实生物)联合治疗肝癌、与JS001联合治 疗胆管癌、与JS001联合TACE治疗晚期肝癌、与CS1001(抗PD-L1单抗基石药业) 联合治疗晚期肿瘤的研究。
(二)外用重组人凝血酶(泽普凝®)
外科手术局部止血药物市场前景广阔。中国外科手术数量增长迅速,根据中国 卫生健康统计年鉴数据,中国医疗机构住院手术台数由2014年的4383.9万台增长 到2019年的6930.4万台,期间年复合增长率达到了11%。2020年由于疫情原因, 手术台数降为6663.7万台。但目前中国人口老龄化形势严峻,再加上医疗机构数量 的进一步增加、分级诊疗制度的实施、外科手术相关器械和医技的进步等因素,在 疫情缓解后,预计中国外科手术台数会出现短暂反弹,并在未来持续快速增长。根 据弗若斯特沙利文等公司的研究报告,中国外科手术台数在未来年复合增长率为 8.0%,预计2030年达到15,195.5万台。随着中国手术台数的增长,外科手术局部 止血药物市场亦将呈现出较为稳定的增长,预计外科手术局部止血药物市场规模将 于2023年及2030年分别达到103亿元及160.3亿元,市场前景广阔(此市场规模预 测并未考虑疫情影响,但预计疫情形势减缓后,市场会出现短暂反弹并在之后持续 高速发展)。

重组人凝血酶是公司自主研发的生物大分子药物,是基于复杂重组蛋白新药研 发及产业化平台开发的一种高度特异性人丝氨酸蛋白酶,相较于其他止血材料;重 组人凝血酶在特异性更高,疗效更好的同时,拥有更低的过敏和感染风险;成熟的 重组蛋白工艺相较于直接从血浆中进行提取成本也更低。外用重组人凝血酶可以在 手术中直接局部作用于出血的伤口,包括直接喷洒于伤口、联合止血海绵使用,或 者作为纤维蛋白和血小板封固剂的成分之一等,可大幅减少因系统性给药带来的临 床副作用;同时因其局部给药的优势,可在系统给药的基础上进一步扩大适用人群。 由于其快速止血的特点和安全性上的优势,预计在未来也会成为外科手术局部止血 药物中的重要产品。此外,泽璟公司的重组人凝血酶也是唯一一个经过合规临床试 验获得成功的生物外用止血药,对其未来上市后的临床应用推广具有很大的帮助。
国内唯一重组人凝血酶,局部给药优势显著。中国现有的外科手术局部止血药 物主要为人源/畜源凝血酶以及纤维蛋白粘合剂;此类产品已进入医保目录,且均 有多个产品上市,上市标准相对落后。蛇毒血凝酶主要可以用于术后静脉给药,加 之其在外科手术外用止血的标签外用药,也是是外科手术止血用药市场的最主要参 与者,在2018年市场份额占到了79.1%。人源/畜源凝血酶也是较为成熟的外科手 术外用止血用药,主要应用场景在不适用敷料的局部出血以及内窥镜手术的止血等。 纤维蛋白粘合剂也被叫做凝血胶产品,是止血市场的新兴产品类型。
III期结果显著,BLA申请已获受理。独立数据监查委员会(IDMC)对结果审 核后判定ZGrhT002试验有效性和安全性结果符合预期,试验达到预设的主要终点, 预计在12-18个月审评周期内获批上市。外用重组人凝血酶有效安全和合理成本的 产品特征将很有可能替代传统外科止血药品,具备巨大的市场潜力。目前全球范围 内仅有Recothrom为同类产品在境外上市,适用于任何毛细血管和小静脉渗血/小出 血的辅助治疗及任何常规外科止血(如缝合、结扎或烧灼)无效或不适用时的止血。 预计重组人凝血酶销售峰值可突破30亿元。(1)根据中国卫生健康统计年鉴数 据,2020年中国医疗机构住院手术台数为6663.7万台。根据弗若斯特沙利文等公 司的研究报告,中国外科手术台数在未来年复合增长率为8.0%;(2)根据市场现有 止血产品价格,估算重组人凝血酶每台手术价格为250元左右;(3)根据弗若斯特沙 利文的统计,外科手术中使用局部止血药物的渗透率在2018年为52.5%;(4)由于 重组人凝血酶的优异特性,我们预计其会占据主要的止血市场;5)公司BLA申请 已获CDE受理,由于目前已经有充分的临床证据,因此上市概率为95%。
(三)盐酸杰克替尼片(泽普平®)
盐酸杰克替尼片是泽璟制药自主研发的小分子JAK激酶抑制剂新药,属于1类 新药。杰克替尼对Janus激酶包括JAK1/2/3和TYK2具有显著的抑制作用,对JAK2 和TYK2的抑制作用最强。另外,杰克替尼还可以通过抑制激活素受体1(ACVR(1) 活性降低铁调素转录,改善铁代谢失衡,增加血红蛋白,降低骨髓纤维化患者贫血 发生率和减少输血依赖。盐酸杰克替尼片目前正在开展多个免疫炎症性疾病和纤维 化疾病的临床研究,最近用于治疗重型新型冠状病毒的临床试验也获得批准。
1. 杰克替尼治疗骨髓纤维化
骨髓纤维化发病凶险,我国乃至全球市场药物都较为有限。是一种骨髓增殖性 肿瘤,可发展成白血病,目前的治疗手段十分有限,全球仅有三款获批的骨髓纤维 化靶向药,有效性和安全性均存在较大改进空间。盐酸杰克替尼片的目标适应症之 一为中高危骨髓纤维化(MF),包括原发性骨髓纤维化、真性红细胞增多症继发 骨髓纤维化或原发性血小板增多症继发骨髓纤维化。
II期结果有效性安全性均显著优于同类药物,杰克替尼片有望成为中、高危骨 髓纤维化患者的最佳选择。已完成的盐酸杰克替尼片治疗中、高危骨髓纤维化的Ⅱ 临床试验24周随访结果于2021年6月初第26届欧洲血液学协会年会(2021 EHA) 上,作为大会口头报告发表。截止数据公开日,已完成24周随访的104例受试者的 结果显示,杰克替尼片100mgBID和200mgQD治疗中、高危骨髓纤维化患者24周 有效率(ITT集)分别为51.9%和30.8%;两组合并有效率为44.2%。杰克替尼片 100mgBID的有效率显著优于同类进口上市药物芦可替尼在中国骨髓纤维化患者中 的历史数据(27%)。杰克替尼片可以更显著的减轻患者的体质性症状,并可显著 改善贫血,减少输血依赖,克服了芦可替尼常见的严重贫血(47.6% 3/4级贫血)的毒副作用。同时杰克替尼氘代原研药莫洛替尼(momelotinib)的研发公司在被葛 兰素史克已19亿美金收购后,于今年6月向FDA提交了莫洛替尼的上市申请,对比两 者已公布的临床数据,杰克替尼在有效性和安全性上均更胜一筹。

两项注册临床均pre-NDA,杰克替尼有望成为首个中国自主研发成功的骨髓纤 维化靶向新药。两项注册临床研究:(1)杰克替尼片治疗中高危骨髓纤维化III期临床 试验:目前已完成期中分析,独立数据监查委员会(IDMC)对结果审核后判定试 验达到预设的主要终点;(2)杰克替尼片用于芦可替尼不耐受的骨髓纤维化患者的安 全性和有效性的IIB期注册临床试验:该试验结果显示24周时脾脏体积较基线缩小 ≥35%的受试者比例,即主要疗效终点达43.2%,达到预设的统计学标准,结果稳 健。基于以上两项试验结果,公司正全速推进盐酸杰克替尼的上市进程。除此之外, 杰克替尼片治疗芦可替尼难治复发的骨髓纤维化患者的安全性和有效性的II期临床 试验亦在进行中,此适应症还获得了美国FDA的孤儿药资格认定,并已获得FDA的 临床试验许可,已经在美国启动了I期临床。
预计杰克替尼治疗骨髓纤维化销售峰值可突破5亿元。(1)根据弗若斯特沙利文 的数据,我国骨髓纤维化发病人数近几年在6万左右;(2)芦可替尼2021年中国区销 售达7亿人民币,患者渗透率增长迅速,预计2030年中国骨髓纤维化靶向药市场的 临床可惠及人口渗透率将达到30%左右;(3)杰克替尼亦将成为芦可替尼不能耐受或 治疗失败的骨髓纤维化唯一选择;(4)根据芦可替尼目前的国内售价推测杰克替尼纳 入医保后每周期治疗费用为50000元;5)目前杰克替尼2项注册临床取得成功,即 将进行NDA,临床证据充分,预计2023年获批,上市概率为90%。
2. 杰克替尼治疗重症斑秃
斑秃患者精神负担大,治疗手段有限。斑秃(AA)是一种常见的炎症性非瘢 痕性脱发,是全球发病率较高的一种脱发症状。这种疾病的临床表现为突然的、不 明原因的局部性或者全部性脱发,并同时形成显著斑块状脱发,易对患者造成沉重 的精神负担。斑秃症状经常在儿童时期就会首次发作,任何年龄、性别和种族的人 群都可能患上斑秃。公开资料显示,目前斑秃的治疗手段有限,尚无特效治疗的获 批药物。研究表明,斑秃是一种由免疫介导的过程引起的自身免疫性疾病,科学家 们在斑秃患者中观察到炎症介质的增加,最显著的是干扰素(IFN)-γ和白细胞介 素(IL)-15,它们是依赖JAK-STAT通路激活和增殖自身反应性T细胞的细胞因子, 因此JAK-STAT被认为是斑秃治疗中有吸引力的一个信号通路。

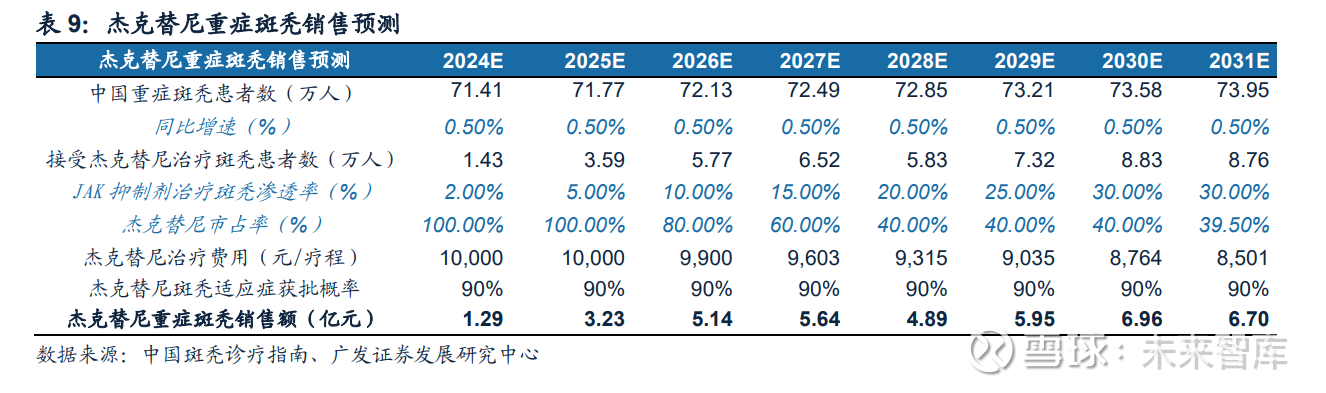
II期结果疗效显著,受到国际皮肤与性病学界的高度认可。2021年10月,杰克 替尼片治疗重度斑秃的II期临床研究结果入选第30届欧洲皮肤与性病学会(EVDA)的口头报告。研究结果显示:82例完成24周疗效评价的受试者中,杰克替尼50mg 每天两次、150mg每天一次和200mg每天一次三组的有效率分别为59.2%、63.3% 和60.0%;各组在第24周SALT评分相对基线的中位变化分别为52.25%、58.13%和 54.33%;包括未完成24周疗效评价的111例受试者,三组总体有效率则分别为 50.0%、48.7%和37.5%。各剂量组的耐受性和安全性良好。目前,公司正在开展 盐酸杰克替尼片治疗重症斑秃的III期临床试验。今年6月,口服JAK抑制剂巴瑞替尼 已获得FDA批准用于治疗成人重症斑秃,验证了此靶点在治疗斑秃上的应用潜力。 除此之外,全球已有多款用于治疗斑秃的JAK抑制剂处于临床中后期研究阶段。
预计杰克替尼治疗重症斑秃销售峰值接近7亿元。(1)根据中国斑秃诊疗指南 (2019),我国斑秃的患病率为0.27%,我国患者数为400万左右,其中重症斑秃患 者人数约为70万人;(2)目前免疫抑制剂治疗斑秃尚属新型疗法,新药上市需要逐 步教育市场;(3)根据目前市场现有斑秃药物和JAK抑制剂价格假设杰克替尼治疗斑 秃每疗程费用为2万元;(4)公司正在开展盐酸杰克替尼片治疗重症斑秃的III期临床 试验,II期试验数据优异,预计2024年获批,上市概率为90%;(5)目前国内仅有杰 克替尼在斑秃适应症上处于III期临床阶段,预计上市后市占率为100%,后续会面 临竞争压力。
3. 杰克替尼治疗中、重度特应性皮炎
2022年6月1日,泽璟制药宣布启动盐酸杰克替尼片治疗中、重度特应性皮炎 III期临床试验。特应性皮炎是一种慢性、复发性、炎症性皮肤病。据弗若斯特沙利 文统计,2020年中国特应性皮炎患病人数达6,737.3万人,2016年至2020年年复合 增长率为2.7%。预计到2030年,这一数字将达到8,165.9万人。在中国,大约35% 的特应性皮炎患者为中重度特应性皮炎患者。预计2025年中国特应性皮炎药物市场 规模将达到126.2亿元,2030年中国特应性皮炎药物市场规模可达299.4亿元。杰克替尼治疗特应性皮炎亦处于III期临床试验阶段。在中国,辉瑞等公司的JAK抑制剂 已获批上市,而恒瑞的JAK抑制剂也处于III期临床试验阶段。尽管处于较多的竞争 药物, 考虑到特应性皮炎广阔的市场前景,杰克替尼有望占有一席之地。
4. 杰克替尼治疗中、重度特应性皮炎
目前,盐酸杰克替尼片治疗移植物抗宿主病获得了临床试验许可,正在开展用 于治疗激素反应不足或不耐受的急性移植物抗宿主病患者安全性和有效性的多中心 II期临床试验。此外,盐酸杰克替尼片治疗特发性肺纤维化、强直性脊柱炎、中重 度斑块状银屑病等适应症均在II期临床试验阶段。近日,盐酸杰克替尼片用于治疗 重型新型冠状病毒肺炎患者的临床试验也获得批准,公司将开展相关II期临床研究。
(四)注射用重组人促甲状腺激素(赛诺璟®)
分化型甲状腺癌是甲状腺癌的主要亚型,约占甲状腺癌新发病例数的90%以上。 近年来,由于早期诊断手段的进步和常规筛查,分化型甲状腺癌新发病例数以远超 其他癌种的速度增加。由于中国甲状腺癌流行病学数据的增长和未来复查监测与辅 助治疗的需求增大,分化型甲状腺癌术后辅助放射性碘清甲治疗及术后辅助诊断的 市场空间将不断增大。 注射用重组人促甲状腺激素(rhTSH)是公司自主研发的生物大分子药物,属 于3类治疗用生物制品。人体内源性的促甲状腺激素(TSH)是糖蛋白激素家族成 员,主要在人垂体表达、分泌入血并和表达于甲状腺细胞和高分化的甲状腺癌细胞 表面的hTSHR蛋白结合,可刺激碘摄取和有机化,以及甲状腺球蛋白(Tg)、三 碘甲状腺原氨酸T3和甲状腺素T4的合成和释放。rhTSH与TSH氨基酸序列完全一致。 rhTSH激活甲状腺细胞的效应是增加放射碘的摄取,可以扫描检测或者放射碘杀伤 甲状腺细胞。rhTSH激活也可以导致甲状腺细胞释放甲状腺球蛋白(Tg),甲状腺 球蛋白是血液标本中甲状腺癌的肿瘤标志物。 目前公司已经启动该产品用于分化型甲状腺癌患者术后治疗和辅助诊断的两项 III期注册临床试验。已有的临床试验结果显示,rhTSH用于分化型甲状腺癌患者的 术后辅助诊断与传统撤除甲状腺激素方法相比具有较好的一致性和良好的安全性。
预计注射用重组人促甲状腺素销售峰值可突破2亿元。(1)根据IARC官网公布的数据,我国2020年甲状腺癌新发患者数为22万人,其中DTC是最常见的类型, 占所有甲状腺癌的90%以上;(2)一般转移或复发的患者会接受碘治疗,预估占到 15%,也有出现更好治疗手段的风险;(3)目前促甲状腺素α(Thyrogen)国内价格 在1.5万元左右,预计注射用重组人促甲状腺素价格为1万元/次;(4)根据公司正在 进行的临床试验及其数据,预计注射用重组人促甲状腺素将于2025年获批,上市概 率为90%。

(五)近期 IND 产品
1. ZG005(双特异性抗体PD-1/TIGIT)
公司首个获批IND双抗,子公司助力加入双抗争夺战。ZG005是泽璟制药从控 股子公司GENSUN引进的双特异性抗体,是公司首个肿瘤免疫双特异性抗体,近 日先后被中国NMPA和美国FDA批准,开展治疗实体瘤患者的临床试验,是全球第 3个进入临床试验的抗PD-1/TIGIT双特异性抗体药物。 ZG005是公司首个重组人源化抗PD-1/TIGIT双特异性抗体,为创新型肿瘤免疫 治疗生物制品,注册分类为1类,有望用于治疗多种实体瘤。目前全球范围内尚未 有同类机制药物获批上市。ZG005拥有双靶向阻断PD-1和TIGIT的作用,既可以通 过有效阻断PD-1与其配体PD-L1的信号通路,进而促进T细胞的活化和增殖;又可 以有效阻断TIGIT与其配体PVR等的信号通路,促使PVR结合CD226产生共刺激激 活信号,进而促进T细胞和NK细胞的活化和增殖,并产生两个靶点被同时阻断后的 协同增强免疫系统杀伤肿瘤细胞的能力。临床前研究结果显示,ZG005具有显著且 长效的抗肿瘤作用,疗效优于单药(抗PD-1抗体或抗TIGIT抗体)及联合给药; ZG005在非人灵长类动物中显示出药物半衰期等方面优良的药代动力学特征及良好 的安全性特征。有望成为治疗实体瘤的肿瘤免疫创新型生物制品,丰富泽璟制药分 子靶向和肿瘤免疫双管齐下的肿瘤药产品管线。
2. ZGGS18(VEGF/TGF-β双功能抗体融合蛋白)
第二个双抗IND,公司抗体平台获有力验证。ZGGS18是公司及子公司 GENSUN通过双/多特异性抗体研发平台联合开发的一个全新双功能抗体融合蛋白 药物,近日先后被中国NMPA和美国FDA批准开展治疗实体瘤患者的临床试验,有 望成为治疗晚期实体瘤的创新型生物制品。ZGGS18是公司第二个实现中美双报的双特异性抗体类药物, 标志着公司的新型抗体研发平台逐步步入收获期。 ZGGS18是一种重组人源化抗VEGF/TGF-β的双功能抗体融合蛋白,可以特异 性地结合血管内皮生长因子(VEGF)和“捕获”转化生长因子-β(TGF-β),起 到抑制肿瘤新生血管形成和降低肿瘤转移发生等协同抑制肿瘤生长的多重作用。另 外,ZGGS18也可以改善和调节肿瘤微环境,从而可以和抗PD-1/L1抗体、以及抗 PD-1/TIGIT双特异性抗体ZG005等肿瘤免疫治疗药物联合增强肿瘤杀伤作用。 临床前研究结果显示,ZGGS18在人非小细胞肺癌、结直肠癌等模型上具有显 著的肿瘤抑制作用,且在和抗PD-1抗体联合用药后,可以导致显著比例的小鼠肿 瘤完全消退,说明ZGGS18具有强效的肿瘤杀伤作用和增强肿瘤免疫治疗药物疗效 的潜力。ZGGS18在非人灵长类动物中显示出长半衰期等优良的药代动力学特征及 良好的安全性特征。
3. ZG19018(KRAS G12C选择性共价抑制剂)
已获批IND并开展临床,跻身KRAS G12C突变肿瘤的广阔市场。KRAS (Kirsten rats arcomaviraloncogene homolog,Kirsten大鼠肉瘤病毒癌基因同源物) 据弗若斯特沙利文统计,2019年KRAS突变的NSCLC、CRC及胰腺癌发病人数在 中国约为19万人、17.6万人和10.3万人,在美国约为4.85、5.82万人和5.39万人。 其中KRASG12C突变的NSCLC、CRC及胰腺癌发病人数在中国约为8.37万人、 1.45万人和2100人,在美国约为2.13万人、4800人和1100人。KRAS曾被认为是 “不可成药”靶点,因为其分子小,表面光滑,几乎没有能够被药物结合的“口 袋”。此外,由于KRAS与GTP结合具有极强的皮摩尔级别的亲和性,因此药物很 难与GTP竞争结合KRAS。KRAS-G12C突变在失活状态下半胱氨酸暴露,通过小 分子抑制剂共价结合降低了 KRAS与GEF的亲和力,阻止GEF催化GTP替换GDP, 导致KRAS-G12C被锁定在失活状态。

ZG19018是由公司自主研发的KRAS G12C选择性共价抑制剂,属于1类小分 子抗肿瘤新药,具有全球知识产权。ZG19018片治疗KRAS G12C突变的晚期恶性 实体瘤的临床试验于2021年12月获批。目前全球范围内仅有一款同类机制药物获 批上市。美国安进公司的KRAS G12C共价抑制剂Sotorasib(AMG510)于2021年 5月被美国FDA加速批准上市,用于治疗携带KRAS G12C突变的非小细胞肺癌 (NSCLC),2021年销售达到9000万美元。临床前研究结果显示ZG19018具有显 著的抑制KRAS G12C突变肿瘤生长和细胞增殖的药效作用,具有药物半衰期长和 口服生物利用度高等药代动力学特征,且在肿瘤和脑组织中具有高药物浓度。 ZG19018有望成为一个治疗KRAS G12C突变肿瘤的创新药。
(六)其他在研项目
1. 处于临床I/II期研发阶段的产品
奥贝胆酸镁片是公司自主研发的2.1类新药,是欧美已上市药物奥贝胆酸改盐 和改晶型的改良型新药。奥贝胆酸镁是法尼醇X受体激动剂,既可以调节胆固醇脂 蛋白和胆汁酸(BAs)的代谢,又可以改善免疫炎症和纤维化。因此,奥贝胆酸镁 有望开发成治疗原发性胆汁性胆管炎(PBC)、非酒精性脂肪肝炎(NASH)、非 酒精性脂肪性肝病(NAFLD)、胆结石、原发性硬化性胆管炎(PSC)等的药物。 本品原研药物奥贝胆酸已于2016年6月和12月分别获得美国FDA和欧盟委员会批准 用于原发性胆汁性胆管炎(PBC)治疗,根据奥贝胆酸生产商Intercept公司发布的 公开数据,2019年奥贝胆酸在欧美市场的销售额为2.496亿美元,2020年前三季度 在欧美市场的销售额为2.294亿美元。到目前为止,奥贝胆酸还未在我国上市。 另外两种产品,奥卡替尼胶囊治疗ALK阳性且经克唑替尼治疗失败的晚期非小 细胞肺癌(NSCLC)患者的II期临床试验和盐酸杰克替尼乳膏治疗轻中度斑秃(外 用)和轻中度皮炎(外用)处于 I/II 期临床试验阶段也都在同步推进中。
2. 处于临床前研发阶段的产品
目前有6个在研药品处于临床前研发阶段,其中ZG170607为小分子抗肿瘤新 药,ZG1905为含重组人凝血酶止血产品,ZG006、ZGGS001、GS11和GS15 为 抗肿瘤多靶点抗体新药,公司正积极推进这些新药的研发进程。
3. 子公司GENSUN合作产品
子公司GENSUN致力于发现和开发新型抗体。目前拥有三个候选药物研发平 台:TriGen平台为三特异抗体研发平台,可以突破抗体两个Fab段的限制,赋予分 子结合三个不同靶点的能力;CheckGen平台可以产生以免疫检查点为靶点的双特 异抗体候选新药;TGen平台为新型双特异抗体分子开发平台,所产生的候选药物 分子可以用作单一药物治疗,可以彼此组合联合用药,也可以与抗PD1/PD-L1治疗 药物组合。GENSUN授予母公司泽璟制药ZG005、ZG006和ZGGS001在大中华地 区的专利独家授权,同时也在积极与外部进行合作:(1)授予齐鲁制药GS02 (TIGIT)大中华地区的专利独家授权;(2)授予开拓药业GS19(PD-L1/TGF-β) 在大中华区的专利独家授权。根据协议条款,GENSUN将获得总计2300万美元的 款项,包括首付款和基于注册、临床开发阶段的里程碑款项。此外,开拓药业将根据GS19在大中华区的年度净销售额向GENSUN支付一定比例的特许权使用费。
三、 盈利预测
现阶段纳入估值的核心产品
纳入现阶段测算的主要为已上市、已申报上市以及注册研究取得积极结果的项 目,包括多纳非尼、外用重组人凝血酶、杰克替尼以及注射用重组人促甲状腺激素 四个品种的多项适应症;对于除上述条件之外的临床前或临床早期项目,基于谨慎 性考虑将根据其研究推进进展适时纳入预测模型。我们对于满足上述条件的产品根 据所处不同阶段假设了相应的成功概率,范围在80-90%之间。成功概率假设的考 虑因素包括:在研品种已经披露的临床试验数据、同类竞争品种已经披露的临床试 验数据、该适应症的临床阶段等。
多纳非尼已于2021年获批上市用于治疗晚期肝癌,预测销售峰值可突破15亿 元;甲状腺癌适应症于2022年获批,预测销售峰值接近2亿元。 外用重组人凝血酶III期结果显著,目前BLA申请目前已获受理, 预计于2023年 上市,预测销售峰值可突破30亿元。 杰克替尼治疗骨髓纤维化2项注册临床已取得成功,公司即将提交上市申请, 预计于2023年获批,预测销售峰值可突破11亿元;同时杰克替尼治疗重症斑秃的III 期临床试验也在进行中,目前公布的II期结果疗效显著,预计于2024年上市,预测 销售峰值可突破6亿元。 注射用重组人促甲状腺激素目前正在进行分化型甲状腺癌的辅助治疗和辅助诊 断两个注册性III期临床试验,预计于2025年获批,预测销售峰值可达2亿元。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)
详见报告原文。
精选报告来源:【未来智库】
股票
MORE>- 最近发表
- 标签列表
-
-
SH603855 SH603987 SH688733 SZ002470 SH688677 SH600767 SZ002879 SZ002531 SZ300377 SH600522 SZ301055 SH600368 SZ301032 SZ000695 SZ300392 SZ002790 SZ002250 SH600381 SH605198 SH688219 SH688126 SZ000829 SZ300650 SH688700 SZ002142 SH600007 SZ002475 SH600989 SZ300879 SZ000993 SH603115 SZ000547 SZ300838 SH605337 SZ300366 SZ000996 SZ300716 SH600533 SZ002376 SZ301086 SZ300249 SZ301071 SZ300497 SH605128 SH603045 SH600106 SH603081 SZ002695 SZ300179 SH601999

